
Réactions chimiques exothermiques. Facteurs de
risque et prévention
Exothermic chemistry reactions. Risk and prevention factors
Redactora:
Silvia Calvet Márquez
Doctora en Ciencias Químicas
CENTRO NACIONAL DE CONDICIONES DE TRABAJO
| Para que un proceso químico sea seguro, es importante conocer los riesgos que acompañan a las reacciones químicas. Con este fin se han desarrollado esta serie de Notas Técnicas de Prevención, cuyo objetivo se ha centrado fundamentalmente en lo relativo a la regulación y control de la temperatura de un proceso y a las desviaciones que ésta puede sufrir durante una reacción exotérmica. En particular, en esta primera Nota Técnica se efectúa un planteamiento analítico de los riesgos previsibles y una revisión de los factores clave para el control térmico. En la segunda NTP, se explican los medios de los que se dispone para medir y regular la temperatura de un proceso, además de darse información sobre la fiabilidad de estos componentes y sistemas. La pérdida de control de una reacción es el origen de graves accidentes en la industria química, por ello la tercera y última NTP de la serie consiste en un análisis estadístico de accidentes ocurridos en la industria debido a la pérdida de control de una reacción química. |
En las industrias de proceso, los reactivos químicos se convierten en otros productos de manera bien definida y controlada. El descontrol de las reacciones químicas ocurre bajo condiciones anormales, por ejemplo por un mal funcionamiento del sistema de refrigeración o por una carga incorrecta de reactivos. Temperatura, presión, catálisis y contaminantes tales como el agua, oxígeno del aire y lubricantes de equipos pueden modificar las condiciones bajo las cuales las reacciones tienen lugar.
Casi todas las reacciones químicas muestran un efecto térmico. Cuando se produce calor durante una reacción (exotérmica), puede tener lugar una situación peligrosa dependiendo de la velocidad de la reacción, la cantidad de calor generada, la capacidad del equipo para eliminar el calor y la posible generación de gases.
Aunque la descomposición térmica (y descontrol) a menudo se identifica con la reactividad inherente de los productos químicos involucrados, no se debe olvidar que el peligro puede aumentar debido a otras reacciones inducidas e indeseadas. Estas reacciones inducidas pueden iniciarse por calor, contaminación o por medios mecánicos (por ejemplo: golpes, fricción, cargas electrostáticas, etc.).
Cuando hablamos de la perdida de control de una reacción estamos refiriéndonos al desarrollo incontrolado de una o diversas reacciones exotérmicas.
Una reacción química de naturaleza exotérmica es aquella que transcurre generando calor y, este desprendimiento de energía, puede incluso ocasionar sucesos catastróficos si se descontrola totalmente. Sin embargo, hay que hacer hincapié en que no sólo las reacciones fuertemente exotérmicas son potencialmente peligrosas.
También, las débilmente exotérmicas pueden originar un incremento de temperatura suficiente para permitir la aparición posterior de otra reacción fuertemente exotérmica; es decir, la aparición de una reacción secundaria no deseada, como por ejemplo una descomposición o polimerización.
Si en un sistema de reacción la velocidad de generación de calor es superior a la velocidad a la que éste se elimina, la temperatura de la masa de reacción empieza a aumentar considerablemente. Debido a este aumento de la temperatura, la velocidad de la reacción se acelera y con ella la velocidad de desprendimiento de calor, conduciendo a un posible descontrol térmico. Esta pérdida de control ocurre porque la velocidad de autocalentamiento de una reacción (y la energía térmica producida) aumenta exponencialmente con la temperatura, mientras que la disipación de calor aumenta sólo como una función lineal de la temperatura (2).
La perdida de control de una reacción puede tener lugar no únicamente en el reactor químico durante un proceso productivo, sino también en otras unidades como columnas de destilación, durante la purificación, en tuberías o en depósitos de almacenamiento.
Una reacción fuera de control puede desencadenarse por diversas causas (6) como, por ejemplo, una pérdida de la capacidad refrigerante del sistema (provocada por la pérdida de fluido refrigerante, por disminución del área de intercambio, por disminución del coeficiente de intercambio de calor, por una temperatura de refrigeración demasiado alta, o por pérdida de la agitación), alteraciones en la materia prima utilizada como reactivo (en su concentración, en las características del flujo de adición, presencia de impurezas, etc.), o incluso por causas externas (fuego, etc.). Dentro del apartado sobre Medidas preventivas se comentarán, de modo más extenso, estas desviaciones.
Pese a que el origen de la pérdida de control de una reacción química puede ser muy diverso, en la mayoría de casos su resultado después de iniciarse es parecido y las consecuencias de la perdida de control dependen principalmente de la energía térmica de la masa de reacción en el momento del descontrol, más que de la causa que la ha provocado. La energía liberada repentinamente puede causar daños, heridos y/o muertos por el efecto directo de las altas temperaturas y presiones, y puede causar enfermedades y muerte por la liberación de sustancias tóxicas.
Las consecuencias de una reacción fuera de control pueden ser muy diferentes: desde la simple formación de espuma que inunda la cámara del reactor, hasta un aumento sustancial de la temperatura, al cual le sigue una elevación de la presión generada por los gases producidos en la descomposición o ebullición, o por la presión de vapor de los líquidos en el reactor. Si esta presión no es aliviada, el reactor puede sufrir sobrepresión y, en el peor de los casos, conducir a una explosión.
Una explosión es una transformación rápida de un sistema material, en el cual se libera una cantidad elevada de energía en un periodo de tiempo corto, a la vez que hay una emisión de gas eventualmente inflamable. Cuando el origen de la transformación se debe a un aumento de la temperatura, se habla de explosión térmica. Este aumento de la temperatura puede ser de origen externo o de origen interno. Todo proceso químico exotérmico mal dominado, por desconocimiento de la energía producida o por insuficiente evacuación de la energía calorífica emitida, puede derivar en un régimen de explosión térmica incontrolable.
En resumen, puede producirse una explosión por descontrol térmico con la combinación de dos o más factores de los listados a continuación:
desprendimiento elevado de calor de la reacción principal
desprendimiento elevado de calor de la posible descomposición de reactivos
desprendimiento elevado de calor de una reacción secundaria
acumulación de reactivos o productos intermedios
eliminación insuficiente del calor generado
materiales involucrados térmicamente peligrosos
pérdida de solvente (disipador de calor) o de refrigerante
presencia de una fuente de ignición
A la hora de valorar la probabilidad de encontrarnos con un caso de pérdida de control hay que tener en cuenta cinco factores:
La temperatura inicial, que puede ser la de operación, la siguiente a otro tipo de operación, la siguiente a otro tipo de incidente o la del medio que se utiliza como calefacción.
El potencial energético del sistema, es decir, la cantidad de calor que liberarían las reacciones químicas que se consideran posibles.
Otras fuentes de calor que puedan generarse.
La cinética de la reacción, que determina la velocidad de liberación del potencial energético del sistema. Es necesario conocer la liberación de calor en función de la temperatura y de la conversión.
La capacidad de eliminación de calor del sistema, bien sea por intercambio de calor con el exterior o por ebullición de la mezcla reaccionante.
Generalmente resulta difícil predecir con exactitud el comportamiento de un sistema. Además, las consecuencias de un pequeño error de cálculo pueden ser muy graves desde el punto de vista de la seguridad. Por este motivo, se realizan pruebas experimentales que permiten obtener datos sobre la reactividad del sistema cuando no se conoce bien la cinética de la reacción que tiene lugar. Existen numerosas maneras de determinar experimentalmente la reactividad de un sistema y con ello conocer el riesgo intrínseco del propio sistema. La mayoría de ellas utilizan calorímetros que permiten conocer la variación de la actividad exotérmica con la temperatura en condiciones aproximadamente adiabáticas (DTA , differential thermal analysis; DSC, differential scanning calorimetry; ARC, adiabatic reaction calorimetry; o el SEDEX, sensitive detector of exothermic process, entre otros). Aparte de tales ensayos, en muchas ocasiones es preciso recurrir a pruebas piloto antes de trabajar a escala industrial; no basta con determinar las características de la reacción a escala de laboratorio, es necesario también obtener una caracterización de la reacción y de características del escalado que permitan desarrollar un diseño seguro. El objetivo principal de estos estudios es determinar el límite de temperatura por debajo de la cual se puede tener una condición segura de trabajo.
Hay dos casos extremos que pueden considerarse para describir la pérdida de calor de un sistema. En el primero, descrito originalmente por Semenov (8), la temperatura se asume que es uniforme a través de la masa de reacción. Esta situación ocurre en sistemas gaseosos y en sistemas líquidos bien agitados, donde la velocidad de eliminación de calor depende de la transferencia de calor a través de, por ejemplo, el encamisado del reactor.
En el segundo caso, considerado por Frank-Kamentskii (5), la distribución de la temperatura no es uniforme y la pérdida de calor depende de la transferencia de calor a través de la masa de reacción. Esto ocurre en grandes masas de líquido no agitados, polvos y sólidos.
Si tomamos el caso de un compuesto A que se descompone de manera exotérmica (4),
A ® B
y conforme a la ley de Arrhenius, podemos expresar la velocidad de la reacción como:
= (1 - x)n
(I)
donde x es la fracción molar del compuesto A que se ha transformado, Ko es un factor preexponencial de la velocidad, Ea es la energía de activación, T es la temperatura de la reacción y R la constante de los gases perfectos.
Por otro lado, el calor producido por la masa de materia transformada por unidad de tiempo, dQr/dt, es igual al calor de descomposición producido en la reacción global por la velocidad de la reacción, dx/dt:
= DHd ·
= DHd · (1 - x)n
(II)
El calor generado por la reacción tiende a aumentar la temperatura del medio. Con objeto de reducir este aumento de la temperatura, se establece un intercambio térmico entre la masa de reacción y el medio exterior que lo rodea. Este intercambio dQe/dt, puede expresarse mediante la expresión,
= U · s (T - Tex) (III)
siendo U el coeficiente global de transferencia de calor, s la superficie de intercambio y Tex la temperatura del medio exterior.
De la diferencia entre el calor producido por la masa de materia transformada por unidad de tiempo, dQr/dt, y del calor intercambiado con el medio exterior, dQe/dt, se obtiene el calor acumulado dentro del sistema, dQm/dt.
=
-
=
(IV)
en donde el SCp es la suma de las capacidades caloríficas del sistema.
De las expresiones (II), (III) y (IV), puede deducirse la siguiente ecuación de equilibrio térmico:
DHd · (1 - x)n
=
=
+ U · s (T - Tex) (V)
El término U · s · (T - Tex), que corresponde al intercambio térmico entre la masa de reacción y el medio exterior, será más pequeño cuanto mayor sea la variación de la temperatura de la masa de reacción por unidad de tiempo. Un caso límite es aquel en el que dQe/dt sea igual a cero; en ese caso estaremos ante una transformación adiabática (no hay intercambio de calor con el medio exterior). Esta situación es importante tenerla en cuenta cuando se realiza un estudio de la seguridad del sistema en las peores condiciones posibles.
Para una reacción de orden cero1 en un sistema bien agitado y refrigerado, es decir con una temperatura uniforme, se obtiene la llamada gráfica de Semenov (figura 1). En ella está representada la variación del calor dQ/dt frente a la temperatura, T. La curva representa la velocidad de generación de calor de una reacción exotérmica. Esta curva varía exponencialmente debido al término exp (-Ea/RT).
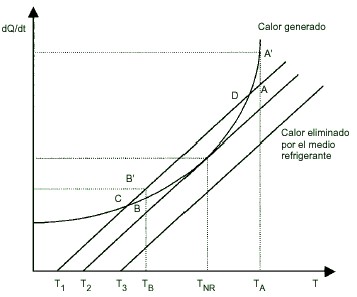
Figura 1. Gráfica de Semenov. Variación del calor generado en una reacción exotérmica según la temperatura
La línea recta representa la habilidad para disipar el calor por parte del medio exterior. La velocidad de eliminación de calor, la cual es proporcional a la diferencia de la temperatura del reactor y la temperatura del refrigerante, es una función lineal de la temperatura y por ello aparece como una línea recta. La intersección de esta línea recta con el eje X es la temperatura del medio refrigerante (Tex). Así, para los diversos valores de la temperatura del medio (T1, T2, T3), obtendremos diferentes líneas rectas.
El equilibrio térmico ocurre en la intersección de la curva de generación de calor y la línea de eliminación de calor (puntos C y D). En el punto C ocurre una operación estable. A una temperatura de reacción más baja que la del punto C, se producirá el propio calentamiento hasta alcanzar el punto C, porque la velocidad de generación de calor excede a la velocidad de disipación. A la temperatura TB, la velocidad de eliminación de calor es superior a la velocidad de generación de calor, así que la temperatura de reacción descenderá hasta alcanzar el punto C. Aunque el punto D es un punto de equilibrio térmico, no es posible una operación estable aquí; una temperatura ligeramente menor que la del punto D ocasionará una disminución de la temperatura del reactor hasta el punto C, mientras que una temperatura ligeramente superior provocará una reacción descontrolada. La importancia del punto D es que la temperatura del reactor aquí es la temperatura crítica por encima de la cual un descontrol de la reacción es irreversible. A la temperatura TA, por ejemplo, la velocidad de generación de calor excede a la velocidad de eliminación de calor y la reacción evolucionará a una situación descontrolada.
Para la temperatura T2 del medio ambiente o del refrigerante tenemos un punto de tangencia con la curva que representa un punto metaestable, lo cual significa que una pequeña perturbación hará que la reacción se descontrole. Así pues, T2 será la temperatura máxima ambiente (condición límite) a la cual el reactivo A puede encontrarse (por ejemplo, almacenado) sin que se produzca una reacción incontrolada. Y, la temperatura TNR del reactivo es a la cual se experimenta la pérdida de control (temperatura sin retorno). A una temperatura T3 del medio, la velocidad de eliminación de calor es siempre insuficiente.
En un reactor equipado con un intercambiador de calor, la capacidad de transferencia de calor de este sistema refrigerante determinará la pendiente de la línea recta, la cual podrá modificarse mediante un cambio en la temperatura del refrigerante, una disminución de la agitación, etc.
Hay tres ámbitos principales de análisis que determinan el diseño de un proceso químico seguro (figura 2).
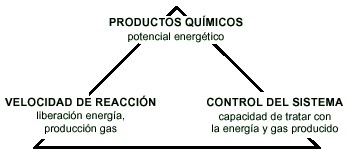
Figura 2. Factores que determinan el diseño de un proceso químico seguro
El primer factor, la energía, está involucrado en la producción de cualquier producto químico. Un diseño seguro (1) requerirá un conocimiento de la energía inherente (liberación exotérmica/absorción endotérmica) durante la reacción química. Esta información puede obtenerse de la literatura, de cálculos termoquímicos o del uso de equipos de prueba y procedimientos. La presión potencial que puede desarrollarse en el proceso es también una consideración de diseño muy importante.
El segundo factor es la velocidad de la reacción, la cual depende de la temperatura, la presión y las concentraciones. Se debe determinar la velocidad de la reacción durante la operación normal y anormal, incluyendo el peor de los casos posibles, con objeto de diseñar un proceso inherentemente seguro.
El diseño de la planta y del equipo son elementos del tercer ámbito. El calor generado por la reacción debe ser eliminado adecuadamente y debe controlarse la producción de gas. También, han de ser considerados los efectos y requerimientos del escalado (la relación entre la planta piloto y el equipo de planta).
Los tres ámbitos y sus correspondientes variables interactúan; por ejemplo, una gran cantidad de energía potencial puede ser eliminada durante una operación normal si la velocidad de liberación de energía es relativamente pequeña y está controlada por una capacidad refrigerante suficiente de la unidad de planta.
Durante el desarrollo y selección de la ruta de proceso final, es importante considerar rutas de proceso alternativas para conocer no sólo los peligros potenciales de la reacción principal sino, también, los de las reacciones secundarias no deseadas. Teniendo identificados los riesgos químicos de un proceso, habrá que decidir como diseñar y operar de modo seguro. Esto significa,
Caracterización de las condiciones de la reacción química y sus riesgos (química bien definida para cada etapa de proceso).
Definición de las condiciones de proceso y del diseño de planta (selección de la instalación, equipos y aparatos; tipo y características adecuadas de los materiales; preparación de manuales de operación, etc.).
Selección y especificación de las medidas de seguridad (medidas a tomar para limitar las condiciones del proceso; sistemas de seguridad).
Implantación y mantenimiento de las medidas de seguridad (cumplimiento de las normas; instrucciones para el control del proceso y para la actuación en condiciones normales).
En la mayoría de las situaciones es necesario suministrar medidas de seguridad adicional, que pueden ser de dos tipos: preventivas o de protección. Las medidas preventivas incluyen el diseño de los procesos de modo que no operen bajo condiciones que puedan permitir una reacción descontrolada (3). El diseño mecánico de la planta, su sistema de control y el modo en que el proceso opera pueden incluirse dentro de las medidas preventivas. Por otro lado, las medidas de protección reducen las consecuencias de una reacción descontrolada.
Resulta más efectivo prevenir una reacción fuera de control que tratar con las consecuencias, de modo que en el diseño se debería preferir las medidas preventivas sobre las de protección. Cualesquiera que sean las medidas de seguridad escogidas, es importante hacer que la planta sea segura bajo todo el rango de condiciones de operación y posibles desviaciones, y que permanezca efectiva después de cualquier modificación. Además, hay que considerar el tipo de proceso que se va a utilizar (continuo, semi-discontinuo o discontinuo).
Algo que ocasiona numerosas situaciones de peligro son las pequeñas modificaciones de proceso que se hacen algunas veces. Por ejemplo, un cambio de catalizador puede ocasionar un aumento notable en la velocidad de reacción. También, un cambio de reactor (en el tipo de acero) puede implicar una violenta descomposición (debido a la presencia de trazas de hierro, las cuales se disuelven en la mezcla de reacción).
El uso de la prevención como fundamento de la seguridad requiere la identificación inicial de los riesgos del proceso y las condiciones bajo las cuales pueden aparecer. Esto permite la especificación de unas condiciones límite o un rango de condiciones, dentro del cual debería mantenerse el proceso para operar de modo seguro, y las medidas necesarias para asegurar que el proceso permanece dentro de este entorno. Esto debería conseguirse con el diseño del proceso y de la planta, pero también depende de los instrumentos, las desconexiones, alarmas y sistemas de control. Además, se requieren procedimientos de organización rigurosos, una estricta ejecución de las condiciones de operación y medidas de mantenimiento adecuadas.
Un entorno de proceso se define por varios parámetros los cuales se examinan a continuación:
Un aumento de la temperatura de proceso puede acelerar una reacción exotérmica o puede causar la descomposición térmica. Por ello, se tiene que definir la temperatura mínima a la cual empezará un descontrol exotérmico bajo las condiciones de la planta, y el margen de seguridad entre esta temperatura y la temperatura de operación normal. Por otro lado, una disminución de la temperatura puede provocar la acumulación de material no reaccionado. Para evitar esta acumulación de material, también deberán definirse las temperaturas mínimas y/o máximas a las cuales ocurre la reacción deseada.
Aunque más adelante se hablará del control y regulación de la temperatura, mencionamos a continuación algunas de las situaciones de riesgo con las que nos podemos encontrar durante un proceso, que ocasionan desviaciones de la temperatura y que, en consecuencia, habrá que evitar:
sistema de refrigeración mal diseñado
pérdida del suministro del refrigerante
pérdida de la capacidad refrigerante por obstrucciones o recubrimientos aislantes
ajuste incorrecto de la temperatura deseada
fallo del sistema de control de la temperatura
fallo de energía eléctrica
avería de la bomba de suministro del refrigerante
otros fallos mecánicos (por ejemplo, válvulas)
Algunas de las medidas preventivas que pueden aplicarse son: utilizar un disolvente con punto de ebullición por debajo de la temperatura a la cual la mezcla de reacción puede descomponerse exotérmicamente; en el caso de necesitar un aporte de calor para iniciar la reacción, el medio calefactor puede ser tal que su temperatura máxima esté por debajo de la temperatura a la cual la mezcla de reacción puede descomponerse exotérmicamente; un sistema de refrigeración por encamisado de circuito cerrado permite mantener mejor la transferencia de calor; realizar una simulación por ordenador, antes de la operación, tanto de la reacción como del sistema de refrigeración, etc.
Puede ser peligroso añadir un reactivo erróneo, la cantidad equivocada de un reactivo correcto (demasiado o poco) o el producto químico correcto en el momento equivocado. Las consecuencias serán cambios en la velocidad de la reacción o la aparición de reacciones secundarias inesperadas.
Asegurar que los materiales son añadidos de modo correcto puede depender mucho del sistema de dosificación y, especialmente, del personal de operación en adiciones manuales, mucho más inseguras que las automatizadas. Es conveniente minimizar las adiciones manuales.
A menudo el proceso puede transcurrir de modo seguro controlando el almacenamiento de los productos químicos, lo cual significa que estén adecuadamente etiquetados y almacenados según sus propiedades físicoquímicas, minimizando el inventario de productos químicos peligrosos. Cuando esto no es posible, o los materiales pueden estar contaminados (un contaminante puede ser cualquier sustancia química utilizada en la planta que no pertenezca al sistema de reacción; esto incluye al refrigerante, el oxígeno del aire, solvente, lubricante, óxido, etc.) o las consecuencias de un error pueden ser graves, es necesario analizar cada material antes de adicionarlo al reactor, o analizar la masa de reacción después de la adición para asegurar que se ha añadido la cantidad correcta. Debería identificarse la velocidad máxima de adición que el sistema de refrigeración del reactor puede manejar, y tomar precauciones para asegurar que no se superan los límites. Un modo de hacer esto es instalar un orificio reductor en la línea de alimentación, para restringir la velocidad de flujo si una válvula de control falla, o calibrar la alimentación del reactor de modo que la cantidad de reactivo que puede ser añadido de una vez esté limitada a una cantidad segura.
El control de la agitación es vital. Puede ocurrir que el diseño del agitador resulte inadecuado para el proceso o que tenga lugar un fallo del agitador, debido a una avería mecánica o causado por un fallo de la energía eléctrica.
Una pérdida de la agitación tiene dos efectos inmediatos: una mezcla pobre de los reactivos y una mala transferencia de calor. Una mezcla pobre implica una acumulación de reactivos y, si la mezcla de reacción contiene más de una fase, puede separarse en capas, las cuales reaccionarán rápida y peligrosamente, particularmente si se restablece la agitación. El efecto de una mala transferencia de calor, que se simula fácilmente en un calorímetro de reacción, puede conducir a una reacción fuera de control debido al aumento de la temperatura, por una inadecuada refrigeración.
Deben tomarse medidas para detectar pérdidas de agitación, ya sea mediante medidas de la velocidad de giro o medidas del consumo de potencia. También, se han de desarrollar procedimientos de emergencia para fallos del sistema de agitación. Debería existir una interconexión de la válvula de cierre de reactivos con el agitador, con el fin de detener la adición de reactivos cuando ocurra un fallo en el mismo. Si el sistema de agitación es por aire, será imprescindible controlar el flujo de aire.
Se debería determinar la velocidad de desprendimiento de los gases bajo condiciones normales y anormales, con objeto de asegurar que es adecuado el sistema de extracción y venteo de los gases. Un aumento de la producción de gas supondrá un aumento de la presión del sistema, el cual puede provocar una explosión si no se dispone de suficiente capacidad de alivio.
Para cada etapa del proceso, hay que determinar el tiempo máximo que la masa de reacción puede mantenerse de modo seguro a una temperatura elevada (estar más tiempo del preciso a una temperatura elevada, puede significar que material térmicamente inestable se descomponga). Se deberán chequear los procedimientos del proceso para asegurar que se cumple lo mencionado anteriormente.
Los operadores han de ser cualificados y estar bien adiestrados en sus actuaciones tanto normales como ocasionales. Se han de definir claramente sus funciones y cumplir estrictamente los procedimientos de operación y las normas de seguridad.
Se requiere instrumentación y sistemas de control para monitorizar parámetros clave como la temperatura, la presión, agitación y refrigeración, y tomar la acción correctora cuando se detecta una desviación de los estándares de operación fijados.
El tipo de instrumentación y su complejidad dependen del diseño de la planta, de las condiciones de operación y de las consecuencias del descontrol de una reacción. Un árbol de fallos es de mucha utilidad para indicar cual es la secuencia de fallos crítica que puede provocar situaciones intolerables. En sistemas donde una pérdida de control podría provocar importantes daños en las personas y/o en la planta, el sistema de control debería satisfacer unos mínimos estándares. Sensores, válvulas, sistemas de control de proceso y otros “hardware” deberán ser adecuadamente fiables. Esto puede implicar la presencia de dos sensores independientes para monitorizar parámetros clave (por ejemplo, temperatura, agitación, etc.). Cuando un sensor detecta un funcionamiento anormal ha de activarse automáticamente la respuesta del sistema de control de desconexión o seguridad. Se ha de asegurar que el sistema esté diseñado con objeto de evitar los fallos más usuales. Es imprescindible evitar que fallos de causa común puedan invalidar diferentes elementos con funciones de seguridad.
Cuando se dispara una alarma, una secuencia automática de acciones debería permitir que la planta permaneciese segura sin la intervención de un operador. La secuencia es probablemente simple para procesos continuos o semi-discontinuos; típicamente implica la interrupción del flujo de entrada de reactivos, asegurando así que no se acumulan. Los reactores discontinuos son más complicados, particularmente si contienen grandes cantidades de material no reaccionado y probablemente necesiten la disposición de medidas de protección tales como venteo de seguridad de emergencia o tanques de vertido por inundación o ahogo de la reacción.
Otro factor a tener en cuenta es el tiempo de respuesta de estos elementos de regulación y control, el cual ha de estar acorde con la velocidad de la reacción. Los elementos de control han de ser idóneos al tipo de proceso.
En principio, los elementos de regulación y control no son elementos de seguridad, excepto si actúan contra posibles fallos de algún elemento o contra desviaciones excesivas de las variables clave.
Las medidas de protección para una operación segura sirven para mitigar las consecuencias del descontrol de una reacción. Incluyen los sistemas de alivio de presión, la extinción, la inhibición y la resistencia a las sobrepresiones del propio recipiente.
Ha de realizarse una evaluación de riesgos global del proceso que se va a llevar a cabo, antes de elegir y diseñar las medidas de protección. La identificación y definición del peor caso posible son particularmente importantes puesto que, en contraste a la prevención, una medida de protección tiene que ser capaz de responder al peor caso de descontrol de la reacción. Además, ha de caracterizarse de modo completo el curso de la reacción y evaluarlo.
Cuando se sabe que es probable que una reacción se descontrole y es necesario un sistema de alivio excesivamente grande, debería considerarse la posibilidad de incorporar un inhibidor a la reacción. En el caso concreto de la temperatura, es recomendable intercalar instrumentos de temperatura independientes y redundantes en el reactor, para actuar frente a una lectura específica de alta temperatura de las siguientes maneras:
Añadir una cantidad considerable de refrigerante o diluyente, para reducir la velocidad de reacción. Esta medida requiere que en el diseño del proceso se prevea2:
elección de un apropiado fluido, el cual no reaccione exotérmicamente con la mezcla de reacción,
volumen libre suficiente en el reactor y
tuberías, instrumentación, etc., para añadir el fluido en el tiempo previsto.
Rápida despresurización del recipiente si el reactor está bajo presión.
Adición de un inhibidor para detener la reacción. Esta medida requiere un conocimiento preciso de cómo la velocidad de la reacción puede estar influenciada y si es posible una efectiva mezcla/inhibición.
Vertido del contenido del reactor en un recipiente que contiene un diluyente frío. Esta opción requiere de un cuidado especial para que no se bloquee la línea de descarga durante el procedimiento de vertido.
En la etapa de diseño de un proceso, una de las elecciones que hay que hacer es la del reactor que se va a usar. El reactor es el equipo principal de la mayoría de procesos y la elección del tipo correcto puede realmente mejorar la seguridad del proceso (2 y 7). La selección del tipo de proceso suele venir dada por consideraciones como, por ejemplo, el tamaño de la planta y la complejidad relativa.
A escala industrial, se utilizan dos métodos de proceso: continuo y discontinuo (o por lotes). Un caso particular de proceso discontinuo es el llamado proceso semi-discontinuo, en el que uno de los reactivos se va adicionando de modo continuo (tablas 1 y 2).
| Tabla 1. Distribución de procesos continuos y discontinuos en diversos sectores industriales (Fuente: Sawyer, P., Computer-controlled batch processing, Institution of Chemical Engineers, 1993). | |||||||||||||||||||||||
|
|||||||||||||||||||||||
| Tabla 2. Comparación entre procesos discontinuos y continuos (Fuente: Sawyer, P., Computer-controlled batch processing, Institution of Chemical Engineers, 1993). | ||||||||||||||||||
|
Los típicos reactores continuos son recipientes agitados, ya sea de modo simple o en cascada, con tuberías de flujo de descarga. En estos sistemas todos los reactivos son continuamente cargados al reactor y los productos son continuamente descargados.
Los reactores continuos se caracterizan por trabajar en condiciones estacionarias, en las que tanto el calor generado como la composición permanecen constantes durante la operación.
Los procesos continuos tienen una principal ventaja, la economía de escala. La producción en gran volumen de un producto estándar generalmente proporciona una buena recuperación del capital invertido. Dado que los requerimientos de productos no cambian significativamente, el proceso necesitará mínimas modificaciones durante su vida de trabajo para mantenerse competitivo.
Además los procesos continuos tienen otras ventajas:
Se requiere menos espacio,
se requiere menos material,
se necesita menos volumen de almacenaje,
que para la misma capacidad en un proceso discontinuo.
Un reactor por lotes es un recipiente agitado en el cual los reactivos son precargados y que se vacía cuando la reacción se ha completado.
La ventaja clave es la flexibilidad de este tipo de procesos. Por eso se utilizan mayoritariamente en la industria química, alimentaria o farmacéutica, donde es muy importante ofrecer una gran variedad de productos e introducir otros nuevos muy rápidamente, ya que estos sectores industriales operan en mercados altamente competitivos. Los equipos de procesos discontinuos se diseñan para manejar un rango de operaciones y productos. La flexibilidad permite manufacturar nuevos productos sin tener que construir una nueva planta o sin tener que hacer grandes cambios de equipo. Esta flexibilidad también permite producir pequeñas cantidades de un producto sin arriesgar toda la productividad.
En los reactores discontinuos, todos los reactivos son cargados inicialmente en el reactor y la reacción continúa entonces hasta completarse. Una desviación excesiva de la reacción, suele ser difícil de controlar. Por ello, frecuentemente para reacciones exotérmicas y para las de dos fases (gas-líquido) se utiliza una operación semi-discontinua. En éstas sólo parte de los reactivos son cargados inicialmente, y el resto de reactivos y catalizador son añadidos de modo controlado. De este modo, si ocurre una pérdida de control es posible detener la carga de reactivos.
Los reactores discontinuos o por lotes se caracterizan por trabajar en condiciones no estacionarias; es decir, que durante la operación la composición y la generación de calor cambian.
La elección del tipo de reactor debería hacerse con el objetivo de evitar reacciones peligrosas no deseadas, maximizando la selectividad (rendimiento) del producto deseado y alcanzando una velocidad de producción elevada (tabla 3). En general, si se pretende una producción pequeña lo más adecuado es utilizar un reactor discontinuo o semi-discontinuo, mientras que para grandes tasas de producción es mejor usar reactores continuos, de “plug flow” (PFR) o reactores de tanque continuamente agitados (CSTR). Las características químicas y físicas que determinan el reactor óptimo son tratadas en libros sobre ingeniería de reacciones y por ello no lo tratamos aquí.
| Tabla 3. Comparación de diferentes tipos de reactores desde la perspectiva de la seguridad (Fuente: CCPs, Guidelines for Chemical reactivity evaluation and application to process design, 1995). | ||||||||||||||||||||
|
||||||||||||||||||||
Para una velocidad dada de producción, los materiales reactivos se van añadiendo al sistema en pequeñas cantidades; por ello, si están involucrados materiales inflamables, con este tipo de procesos el riesgo de incendio se reduce considerablemente.
Los productos intermedios son consumidos tan rápidamente como se forman, minimizando el riesgo si éstos son peligrosos.
Ya que no hay variaciones de las condiciones de proceso con el tiempo, el control automático se puede aplicar más fácilmente. Se reducen los riesgos por un error del operador.
El equipo de proceso no está sujeto a fluctuaciones cíclicas de presión y temperatura.
Cuando puedan tener lugar dos reacciones paralelas, pero sólo interesa una de ellas, un proceso continuo dará rendimientos más elevados.
Cuando están involucradas operaciones peligrosas, las unidades deben ser aisladas unas de otras. La propagación de un fuego o explosión se puede evitar al dividir el proceso en pequeñas unidades aisladas paralelamente.
Cuando la seguridad depende de la pureza del producto, un proceso discontinuo puede ser ventajoso (siempre y cuando se realice un control analítico cuidadoso de la calidad del producto en cada lote).
Para reacciones simples, un proceso discontinuo o semi-discontinuo proporciona rendimientos más altos de producto.
Si el producto deseado se descompone por una reacción consecutiva, el rendimiento será más alto en un reactor discontinuo, que en uno semi-discontinuo. Sin embargo, si son los reactivos los que pueden dar subproductos en reacciones paralelas, una operación semi-discontinua dará rendimientos más altos. De todos modos, si la producción de calor por unidad de masa es muy alta, la reacción puede entonces transcurrir bajo control de modo seguro sólo en un reactor semidiscontinuo.
(1) BARTON, J. and ROGERS, R.
Chemical reaction hazards
A guide to safety. 2nd ed. United Kingdom, Institution of Chemical
Engineers, 1997. 225 p.
(2) CCPs.
Guidelines for Chemical reactivity evaluation and application to process design
New York, Center for Chemical Process Safety of the American Institute of Chemical
Engineers, 1995. 210 p.
(3) CCPs.
Guidelines for engineering design for process safety
New York, Center for Chemical Process Safety of the American Institute of Chemical
Engineers, 1993. 556 p.
(4) CHAHINE, G.
L’explosion thermique. Approches théorique et expérimentale
Cahiers de notes documentaires, 1986, nº 122, p. 59-66. Note ND 1570-122-86.
(5) FRANKKAMENETSKII, D.A.
Diffusion and heat transfer in chemical kinetics
2nd ed. London, Plenum Press, 1989.
(6) GUSTIN, J.L.
Thermal stability screening and reaction calorimetry. Application to runaway reaction
hazard assessment and process safety management
J. Loss Prev. Process Ind., 1993, vol. 6, nº 5, p. 275-291.
(7) SAWYER, P.
Computercontrolled batch processing
Rugby, UK, Institution of Chemical Engineers, 1993. 177 p.
La autora desea expresar su agradecimiento al Centre de Desenvolupament de Processos de Química Fina, del Laboratori General d’Assaigs i Investigacions, y particularmente a Mª Teresa Sanfeliu por los consejos dados, así como al tutor que ha guiado este estudio, Emilio Turmo del Centro Nacional de Condiciones de Trabajo por toda la ayuda y orientación recibida.
Una reacción de orden cero es aquella en la que la concentración de reactivos permanece constante. La velocidad de la reacción es, por tanto, independiente de la concentración de los reactivos. |
|
la capacidad refrigerante de un circuito debería estar sobre dimensionada en un 50%, a fin de disponer de un margen de seguridad ante posibles limitaciones de intercambio térmico. |