
Pesticides organophosphorés (I): aspectes
généraux et toxicocinetique
Organophosphate Pesticides (I): General aspects and toxicokinetics
Redactor:
Jordi Obiols Quinto
Licenciado en Ciencias Biológicas y en Farmacia
CENTRO NACIONAL DE CONDICIONES DE TRABAJO
| En esta NTP se describen las principales características de los plaguicidas organofosforados desde el punto vista químico, las vías y aspectos más sobresalientes de la exposición de la población laboral con riesgo potencial, algunos de los factores de riesgo más importantes, la eficacia de los trajes de protección, así como una idea elemental del camino que siguen desde su absorción, las transformaciones que sufren en el organismo y los correspondientes productos resultantes hasta su eliminación, con la inclusión de los valores de algunos parámetros a fin de dar una idea de la magnitud de estos procesos. |
Los plaguicidas organofosforados constituyen un amplísimo grupo de compuestos de síntesis, en general altamente tóxicos, con un precedente en los gases de guerra, a menudo conocidos bajo el apelativo de ‘gases nerviosos’, entre los que se encuentran el sarin, tabun y soman, y que se desarrollaron de manera especial a partir de la Segunda Guerra Mundial. Las propiedades de estos compuestos como insecticidas fueron el motivo de que ya en 1959 se hubieran sintetizado alrededor de 50.000, al revelarse como útiles elementos de lucha contra las plagas de insectos, por lo que forman parte, como ingredientes activos, de muchos formulados comerciales (en los que se integran distintos componentes, para obtener una mayor eficacia del ingrediente activo).
La fórmula estructural general de estos compuestos, que se caracterizan por la presencia de (en general) tres funciones éster, es la siguiente:

En la que R1 y R2 son radicales alquilo, generalmente metilo o etilo, el grupo X es característico de cada especie química, siendo frecuentemente un radical arilo, y suele contribuir de forma importante a sus propiedades físicas y químicas y biológicas. A tenor de los elementos concretos que ocupen determinadas posiciones en la molécula, los organofosforados se pueden dividir en 14 grupos, de los que los más importantes son: fosfatos, con un O en las posiciones [1] y [2]; O-fosforotioatos (o tionatos), con un S en [1] y un O en [2], S-fosfortioatos (o tiolatos), con un S en [2] y un O en [1]; fosforoditioatos (o tiolotionatos), con un S en [1] y en [2]; fosfonatos, con R1 (en lugar de R1O), O o bien S en [1] y O en [2], y fosforoamidatos, con un O en [1] y un N en [2]
Se trata de compuestos, en general, marcadamente apolares, lo que significa que desde el punto de vista químico la mayoría son escasamente solubles en agua, aunque con grandes diferencias de un compuesto a otro, y desde le punto de vista biológico tienden a disolverse en grasas. Por tal motivo, la piel, donde se encuentra una importante capa de tejido con elevado contenido en lípidos, puede constituirse en una importante vía de entrada. La estabilidad de los organofosforados depende del pH del medio; a pH fuertemente alcalino se descomponen, lo que puede ser utilizado para destruirlos.
Destaca el personal de empresas dedicadas a la aplicación de plaguicidas de tipo agrícola, de tipo ambiental (en interior de locales), trabajadores de empresas agrícolas que manipulan o aplican tales productos; en la industria alimentaria; trabajadores de unidades de salud pública, centros veterinarios; pilotos y personal auxiliar que interviene en las aplicaciones agrícolas aérea, trabajadores de aplicaciones forestales y de tratamientos estructurales de edificios; trabajadores de la desinfección de barcos o grandes almacenes, y, desde luego, los que se dedican a la fabricación, formulación y/o envasado de organofosforados, es decir, su producción industrial.
Aun sin manipular ni utilizar estos productos en ningún momento, puede estar laboralmente expuesto de manera accidental (por circunstancias que no son inherentes a la propia actividad y como consecuencia de tratamientos incorrectos realizados por terceras personas): el personal que trabaja en centros hospitalarios, al que se considera como “grupo de alto riesgo” de exposición por las frecuentes y “programadas” aplicaciones de insecticidas, el de hostelería, oficinas, centros docentes, recreativos, residencias de ancianos, entre otros.
Así mismo, pueden estar expuestas las personas que a tales centros acuden como pacientes (enfermos), simples ciudadanos, niños, adultos o ancianos, muchos de ellos más susceptibles por sus características o condiciones de salud que la mayoría de la población general, lo que constituye un problema de salud pública adicional al que debe prestarse especialísima atención.
En general, el patrón de exposición de un trabajador a un contaminante viene determinado por la concentración, el número de horas y la periodicidad de la misma. Cuando la exposición es única (por un periodo de menos de 24 horas) y a una concentración relativamente elevada, hablamos de exposición aguda. Cuando la exposición se repite diariamente durante un periodo de tres o más meses (sin límite máximo) se dice que la exposición es crónica; situaciones intermedias son la subaguda (hasta un mes) y subcrónica (menos de tres meses), siendo habitualmente (aunque no siempre) las concentraciones más bajas que en la exposición aguda.
La exposición a organofosforados (y plaguicidas en general), se caracteriza porque tales patrones son relativamente fáciles de discernir para los trabajadores de la producción industrial, tiende a ser continua y prolongada, de nivel muy constante, a uno o muy pocos compuestos, y, por tanto, fácil de reducir a límites aceptables, siempre que se adopten y apliquen de manera estricta las medidas de seguridad e higiene industrial adecuadas. De no ser así, el riesgo de enfermedad profesional de los trabajadores por exposición crónica a compuestos organofosforados puede ser elevadísimo, ya que en los procesos industriales se utilizan ingredientes activos con un grado de pureza próximo (o superior) al 95 % (máxima toxicidad, según la especie química implicada; y riesgo de contacto por fugas, vertidos, polvo, etc.) y/o pueden entrar en contacto con importantes cantidades del producto ya formulado.
Por el contrario, la exposición de los trabajadores que utilizan estos productos (manipuladores, aplicadores y similares) es de duración variable, intermitente, muy variable en cuanto al nivel, a numerosos compuestos diferentes (de manera sucesiva en el tiempo o simultáneamente por el uso de mezclas); resumiendo, los usuarios están sometidos a una exposición intermitente, de intensidad variable y múltiple, por lo que el término exposición crónica no se puede aplicar en su sentido habitual.
El personal no usuario de los plaguicidas, al que se refiere el apartado de población con riesgo potencial, puede estar sometido a exposiciones agudas repetidas cada vez que se realiza un tratamiento, sobre todo en los “tratamientos programados”, de carácter “preventivo”, es decir, sin diagnóstico de la existencia de una plaga, de no seguir un protocolo escrupuloso, o no respetando estrictamente, además, el plazo de seguridad. Según la permanencia del ingrediente activo en la zona tratada (estabilidad), frecuencia de los tratamientos y grado de contacto con esos productos, la exposición de este personal puede ser subaguda, subcrónica o crónica.
En el ámbito laboral, la exposición puede tener lugar por las tres vías clásicas: digestiva, inhalatoria y dérmica. La vía digestiva directa se suele considerar como accidental (ingestión de una solución por error o con fines suicidas, o de alimentos directa o indirectamente contaminados). Deberá, por tanto, evitarse en todo momento el contacto de alimentos (y su almacenamiento) con tales productos, así como comer, beber o fumar durante su manipulación o sin lavarse previamente las manos y la cara.
Desde hace muchos años, es bien conocido que las vías inhalatoria y la dérmica están muy estrechamente relacionadas con la exposición en las distintas operaciones en que se pueden manipular este tipo de productos por parte de operarios con distintas actividades o de personas que accidentalmente pueden entrar en contacto con ellos sin manipularlos, tal como ya se ha señalado. En la tabla 1 se presentan los resultados de las exposiciones dérmica y respiratoria en distintas situaciones y para distintos organofosforados. La vía digestiva debe considerarse como una vía “atípica” de entrada en el organismo, pero que puede implicar un riesgo importante cuando se utilizan frascos no adecuadamente etiquetados para contener los formulados o sus diluciones, o se consume tabaco, alimentos o bebidas en el puesto de trabajo, contaminados, durante la manipulación o aplicación del producto o con posterioridad a la misma, sin proceder a una higiene personal adecuada.
| Tabla 1. Exposiciones de los trabajadores a diferentes plaguicidas y en distintas aplicaciones | ||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
La penetración de los plaguicidas a través de los trajes de protección (alcanzando la piel) es función del tipo de prenda utilizado, tiempo de contacto, ingrediente activo (y tipo de formulado), tipo de fibra y tratamiento repelente que se le ha aplicado. Los valores experimentales que van del 0.01 al 21.8 % para un mismo tipo de prenda nueva, o del 0.05 al 31 % en una nueva y otra lavada de un mismo tipo desechable (lo que implica que se debe evitar la reutilización de las prendas de un solo uso). El tiempo de contacto es decisivo: en aplicaciones agrícolas, mientras los porcentajes respectivos de penetración, en dos modelos distintos, a los 5 minutos son inapreciables, a los 15 minutos pueden ser del 0.6 y 2.0 % y a los 30 minutos son de 1.6 y 5.1 %, debido al contacto continuado de la prenda con las hojas húmedas tratadas. Los porcentajes medios de penetración, a través de una prenda desechable, fueron del 2.75 y el 35.38 %, para el clorpirifos y el etazol, respectivamente, y del 18.64 y 38.33 % para estos mismos productos, a través de una prenda reutilizable con un tratamiento repelente del agua. En general, las prendas de algodón, mezcladas con otras fibras, ofrecen una mejor protección.
Se han elaborado diversos modelos teóricos para evaluar cuantitativamente la exposición potencial de los manipuladores de plaguicidas en distintas operaciones (las que tendrían sin utilizar protecciones). Las exposiciones dérmica y la respiratoria durante las operaciones de mezcla y carga, para el percentil 90 (calculado según el modelo holandés a partir de los datos experimentales) se incluyen en la tabla 2, donde se pone de manifiesto que la exposición a los sólidos es muy superior a la de los líquidos. Los valores de exposición dérmica y respiratoria potenciales durante el proceso de aplicación se presentan en la tabla 3. Puede comprobarse que la exposición dérmica potencial es entre 400 y 2000 veces superior a la exposición respiratoria durante la aplicación, dependiendo del sistema empleado y forma de realizarla.
| Tabla 2. Exposición durante la mezcla y carga (percentil 90, según el modelo holandés) expresada en: mg formulado/hora | ||||||||||||
|
||||||||||||
| Tabla 3.Exposición durante la aplicación (percentil 90) expresada en mg aerosol/hora | ||||||||||||||||||
|
||||||||||||||||||
| (*) Estos valores incluyen mezcla y carga |
La absorción de la contaminación no eliminada de la piel (que implica un contacto prolongado y por tanto una mayor facilidad del proceso), especialmente cuando el ingrediente activo está diez, cien o mil veces más concentrado que en la dilución final empleada en la aplicación (como en los procesos de formulación, o manipulación del formulado concentrado), puede ser cuantitativamente muy elevada, frecuentemente conducente a intoxicaciones agudas. Una higiene personal escrupulosa es un elemento preventivo imprescindible, adicional a las medidas de higiene y seguridad a seguir en el desarrollo de la propia actividad.
La toxicidad real por vía dérmica depende de la rapidez con que el ingrediente activo sea capaz de alcanzar la circulación general y de la toxicidad inherente al propio producto. Algunos ingredientes activos se absorben escasamente por esta vía (menos del 1%), mientras otros atraviesan fácilmente la barrera dérmica y la absorción es prácticamente total. La toxicidad aguda por vía dérmica se evalúa mediante la determinación experimental de la DL50: dosis letal media, es decir, la dosis (mg/kg de peso del animal) que causa la muerte del 50 % de los animales a los que se les ha administrado por aplicación sobre la piel.
La absorción por la piel no es uniforme en toda la superficie corporal para un determinado compuesto. En el caso del paratión, la absorción dérmica en distintas zonas del cuerpo humano varía desde el 0 %, en el arco plantar, hasta el 100 %, en el escroto; entre ambas cifras extremas están: 8.6 % en la cara ventral del antebrazo, alrededor del 33 % en distintos puntos de la cara y el 63 % en las axilas.
La temperatura ambiental elevada es otro factor importante que contribuye a favorecer la absorción cutánea. La excreción de p-nitrofenol urinario en voluntarios, tras aplicación la misma cantidad de paratión a la piel, ha demostrado que la absorción por vía dérmica aumenta con la temperatura (tabla 4), probablemente a consecuencia de un aumento de la circulación periférica en estas condiciones; la humedad relativa alta, que también la favorece, actúa de manera similar.
| Tabla 4. Temperatura ambiente y excreción de p-nitrofenol | ||||||||||||
|
La absorción por vía inhalatoria debe ser tomada especialmente en consideración cuando se trata de plaguicidas que se emplean en forma de aerosoles o cuyo ingrediente activo pasa fácilmente al estado de vapor o se trata de un gas. En general, la absorción por esta vía es muy elevada y, si no se dispone de datos experimentales que demuestren lo contrario, se considera que es del 100%. La toxicidad aguda por vía inhalatoria, cuando es potencialmente peligrosa, se evalúa determinando experimentalmente la CL50: la concentración letal media, es decir, la concentración en aire (mg/l) que en una exposición de 4 horas causa la muerte del 50 % de los animales sometidos a ensayo.
En los demás casos la evaluación la toxicidad aguda se realiza administrando el compuesto por vía digestiva a ratas o ratones, obteniéndose así la correspondiente LD50 por vía oral, expresada en mg/kg de peso del animal.
Una vez absorbidos, los organofosforados y sus metabolitos se distribuyen rápidamente por todo los órganos y tejidos, aunque las concentraciones más elevadas se alcanzan en el hígado y los riñones, antes de ser eliminados de manera prácticamente total por la orina y las heces. No obstante, los compuestos más lipofílicos pueden almacenarse en pequeña proporción en los tejidos grasos y el tejido nervioso, dada su riqueza en lípidos, de donde pueden ser posteriormente liberados.
El catabolismo (descomposición en substancias más sencillas) de los compuestos organofosforados una vez absorbidos tiene lugar, en parte, a través de las llamadas esterasas “A”, enzimas que los hidrolizan a una velocidad considerable, actuando como detoxificadoras. Las esterasas “B” no tienen, en general, esta función y, muy al contrario, son las moléculas diana sobre las que los organofosforados actúan en el organismo, ejerciendo así su acción tóxica, como es el caso de la acetilcolinesterasa (con una muy destacada función fisiológica en el sistema nervioso) cuya actividad bioquímica resulta inhibida, con una rapidez e intensidad que dependen de la naturaleza del propio compuesto, además de su concentración. La butirilcolinesterasa, llamada pseudocolinesterasa o colinesterasa sérica, por encontrarse en el suero, es de características análogas a la anterior pero con función detoxificadora frente a los organofosforados.
La acetilcolinesterasa, además de encontrarse en los glóbulos rojos, donde no se le conoce acción fisiológica, regula la transmisión de los impulsos nerviosos en las terminaciones colinérgicas (por hidrólisis de la acetilcolina, que actúa como neurotransmisor, una vez ha alcanzado su destino) de las neuronas preganglionares del sistema simpático y parasimpático (receptores nicotínicos), de las postsinápticas del sistema parasimpático (receptores muscarínicos), de una parte importante de las sinapsis existentes entre neuronas del propio SNC, y de las terminaciones motoras en los músculos estriados (voluntarios), en las uniones neuromusculares, también con receptores nicotínicos (ver figura 1).
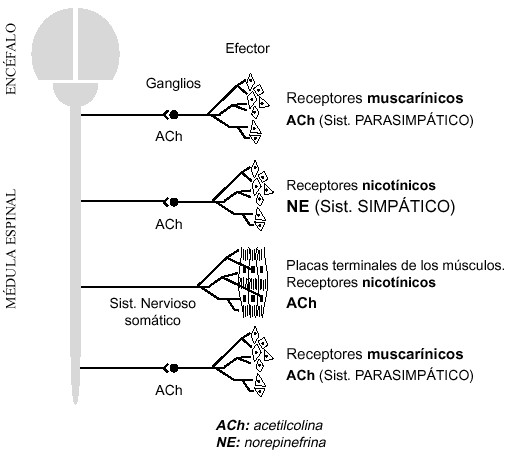 |
Figura 1. Sistema nervioso periférico con los principales neurotransmisores preganglionares y postganglionares, y tipos de receptores en los efectores |
El acúmulo de acetilcolina en cualquiera de esos puntos que se acaban de citar, por inhibición de la actividad colinesterásica, trae como consecuencia la aparición de trastornos de mayor o menor intensidad y de naturaleza distinta. En general, se habla de efectos muscarínicos, (cuando recuerdan los de la muscarina, el agente tóxico de la seta venenosa Amanita muscaria), o de efectos nicotínicos, (similares a los de la nicotina, el agente tóxico de la planta del tabaco, Nicotiana tabacuum), según actúe sobre uno u otro de los referidos tipos de receptores, respectivamente.
El catabolismo de los organofosforados sigue las dos fases habituales de detoxificación de los xenobióticos en el organismo en general, las denominadas fase I y fase Il. Paradójicamente, en ocasiones, el organofosforado requiere que se metabolice antes de convertirse en un compuesto biológicamente activo, y por tanto nocivo, en el organismo. El metabolismo de estos compuestos transcurre principalmente en el hígado, y como resultado final de la transformación de la molécula se originan los “grupos salientes” que son característicos de cada organofosforado en particular (por acción de citocromos P-450), y un total de hasta 8 alquilfosfatos diferentes (por acción de las esterasas A), que son comunes para el conjunto de los organofosforados. De estos últimos, los 6 más frecuentes son los siguientes: el dimetilfosfato (DMP), dietilfosfato (DEP), dimetiltiofosfato (DMTP), dietiltiofosfato (DETP) dimetilditiofosfato (DMDTP), dietilditiofosfato (DEDTP); el dimetilfosforotiolato (DMPTh), y el dietilfosforotiolato (DEPTh) son menos frecuentes. La figura 2 representa el esquema básico del metabolismo de los organofosforados. Todos estos compuestos resultantes son solubles en agua y se eliminan por la orina y las heces (ver figura 3, con los principales alquilfosfatos).
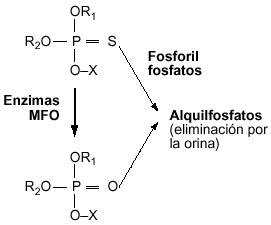 |
Figura 2. Esquema elemental del metabolismo de los organofosforados, papel de la MFO (Mixed Function Oxidase) y transformación final en alquifosfatos |
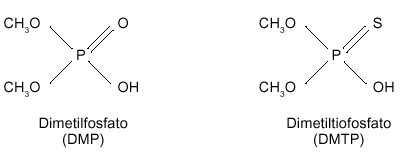 |
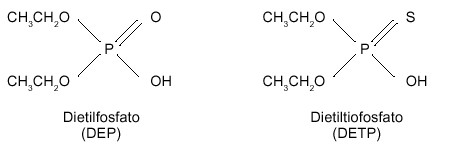 |
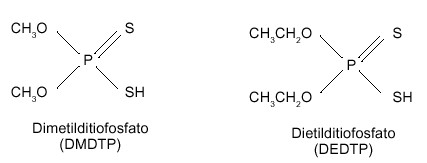 |
Figura 3. Estructura de los dialquilfosfatos, resultantes del metabolismo de los plaguicidas organofosforados |
En términos generales, entre el 75 y el 100 % de los organofosforados administrados por vía oral se transforma en compuestos solubles, entre los que se encuentran los alquilfosfatos (ver figura 2) a los que se acaba de aludir, prolongándose su eliminación urinaria por un periodo que oscila entre las 24 y 48 horas tras la administración (experimental). Debe tenerse en cuenta, no obstante, que la absorción por vía dérmica puede ser más lenta, extenderse durante un periodo más largo y, en consecuencia, la eliminación prolongarse más allá del referido plazo, puesto que representa el resultado de la integración de todo el proceso de absorción.
(1) ABOUDONIA, M., LAPADULA, D. M.
Mechanisms of organophosphorus esterinduced delayed neurotoxicity: Type I and Type II.
Annu Rev Pharmacol Toxicol 30: 405-440. (1990).
(2) DURHAM, W. F., WOLFE, H.R.
Measurement of the Exposure of Workers to Pesticides.
Bull WHO 26: 75-91. (1962).
(3) HARTMAN. E. D.
Neuropsychological Toxicology. Identification and Assessment of Human neurotoxic
Syndroms.
Pergamon Press, New York, second printing, 1989.
(4) LEDESMA , M. J. DELGADO, P. (1994).
Predicción de la exposición a productos fitosanitarios.
Salud y Trabajo, Nº 103: 12-19.
(5) LEVI, P.E., HODGSON, E.
Págs. 141-154 en: Organophosphates, Chemistry, Fate and Effects.
Edted. by Chambers, J.E., Levi, P.E. Accademic Press, San Diego, 1992.
(6) METHNER, M. M., FENSKE, R.
Pesticide Exposure During Greenhouse Applications, Part II. Chemical Permation Through
Protective Clothing in Contact with Treated Foliage.
Appl Occup Environ Hyg 9: 567-574. (1994).
(7) NAMBA, T. et al.
Poisoning Due to Organophosphate Insecticides: Acute and Chronic Manifestations.
Am J Med 50: 475-492. (1971).
(8) NIGG, H. N. et al.
Protection Afforded to Greenhouse Pesticide Applicators by Coveralls: A field
Test.:Arch.
Environ Contam Toxicol 25: 529-533. (1993).
(9) OBIOLS, J. O.
Plaguicidas organofosforados. (Capítulo 16) págs, 253-288. En: Control biológico de los
trabajadores expuestos a contaminantes químicos.
Instituto Nacional de Seguridad e Higiene en el Trabajo, Madrid, 1998.
(10) PEYSTER, A., WILLIS, W.O., y cols. (1993).
Cholinesterase and Selfreported Pesticide Exposure among Pregnant Women.
Arch Environ Health 48: 348-352.
(11) SULTATOS, L. G.
Mammalian toxicology of organophosphorus pesticides.
J Toxicol Environ Health 43: 271-289. (1994).