
Contôle biologique d'expositions à genotoxiques: techniques
cytogénétiques
Biological monotoring of genotoxic exposures: Citogenetic techniques
Redactores:
Xavier Solans Lampurlanés
Licenciado en Ciencias Biológicas
Mª Rosa Hernández Malo
Licenciada en Ciencias Biológicas
CENTRO NACIONAL DE CONDICIONES DE TRABAJO
En la presente Nota Técnica de Prevención, se comentan 2 de los ensayos citógenéticos -Aberraciones Cromosómicas e Intercambio de Cromátidas Hermanas- más empleados para el control biológico de poblaciones ocupacionalmente expuestas a agentes genotóxícos. Los cambios en la estructura de los cromosomas fue una de las primeras formas conocidas de lesión genética producida por la exposición a agentes físicos o químicos. Dependiendo del modo de actuación del agente genotóxico sobre el ADN, las lesiones producidas pueden dar lugar a aberraciones cromosómicas y/o intercambio de cromátidas hermanas. Se indican las bases acerca de los mecanismos de formación de las lesiones en los cromosomas y la aplicación de estas dos técnicas citogenéticas, así como lo que se conoce acerca de su significación biológica. |
El creciente avance de la industrialización ha producido cambios en los diversos ambientes de trabajo. Se estima que existen en el mundo más de 70.000 sustancias químicas y que aparecen alrededor de 1.000 sustancias nuevas anualmente. La exposición a estos compuestos, ya sea durante su formulación, producción o utilización puede tener en algunos casos efectos adversos en la salud de los trabajadores. Estos efectos no tienen por qué estar relacionados con lesiones inmediatas y aparentes, sino que pueden tardar incluso años en manifestarse.
Algunas de estas sustancias pueden ser genéticamente activas, siendo capaces de interaccionar con el material genético (ADN). A las sustancias que pueden provocar algún tipo de modificación en la información genética se las denomina genotóxicas. Es bien conocida la relación entre la exposición a sustancias genotóxicas, ya sea de forma ocupacional, accidental o por estilos de vida (hábitos), y el incremento del riesgo de padecer un cáncer.
El control biológico es una metodología especialmente interesante para la evaluación de la exposición a agentes potencialmente cancerígenos (para los que no se conoce la existencia de niveles umbral de seguridad, el tiempo de latencia entre la exposición y el efecto suele ser muy largo y los efectos finales dependen en gran medida de variaciones interindividuales).
Se han desarrollado muchos ensayos biológicos a corto plazo para la identificación de la exposición a agentes genotóxicos (véase NTP 192). Entre todos ellos, las técnicas citogenéticas, que permiten detectar lesiones en los cromosomas de linfocitos de sangre periférica, se han mostrado como una eficaz herramienta en los programas de control biológico de trabajadores expuestos a sustancias genotóxicas.
La exposición a agentes con potencial efecto genotóxico, tanto físicos como químicos, puede producir, dependiendo del tipo de lesión inducido sobre el ADN, dos tipos de anomalías cromosómicas: aberraciones cromosómicas e intercambio de cromátidas hermanas, que pueden ser detectadas mediante las técnicas citogenéticas. A los agentes físicos y químicos capaces de inducir tales cambios se les denomina clastógenos.
La base para la aplicación de las técnicas citogenéticas para el control biológico es el principio que el grado de lesión genética en tejidos no diana (en este caso, linfocitos de sangre peritérica), refleja lo que ocurre en las células verdaderamente importantes en el potencial desarrollo de un proceso cancerígeno. De esta forma, los linfocitos de sangre periférica pueden ser contemplados tanto como indicadores de la exposición como del efecto producido en otras células de organismo.
El control citogenético de poblaciones está normalmente relacionado con exposiciones crónicas a bajas dosis de potenciales agentes genotóxicos. En este caso, las anomalías cromosómicas observadas en un momento dado son el producto de, al menos, tres procesos competitivos entre sí:
Inducción prolongada de lesiones.
Reparación continuada de las lesiones producidas.
Eliminación y redistribución de los linfocitos en el sistema circulatorio.
Los linfocitos de sangre periférica comprenden, atendiendo a su origen y función, dos categorías principales de tipos celulares: las células B, que en el adulto derivan de la médula ósea, y las células T que derivan del timo. La proporción de ambos tipos celulares en adultos es de, aproximadamente, el 10-15% de linfocitos B y el 60-70% de linfocitos T. Ambos tipos de linfocitos tienen receptores de membrana para antígenos específicos que promueven su proliferación.
La función principal de las células B es la de producir anticuerpos, que se unen de forma específica con el antígeno que provocó su estimulación y lo destruyen. En el caso de las células T, éstas promueven la respuesta inmune de producción de anticuerpos por los linfocitos B y, por otro lado, destruyen las células infectadas por virus.
Los linfocitos de sangre periférica, como sistema celular de ensayo, presentan una serie de características que los hacen especialmente apropiados para su utilización en estas técnicas:
Disponibilidad fácil y en gran número (1 ml de sangre contiene de 1 a 3 millones de linfocitos).
Crecimiento en cultivo fácil tras ser estimulados con un mitógeno (normalmente fitohemaglutinina). Los linfocitos T son los primeros en ser estimulados a entrar en mitosis.
Poseen una amplia distribución en el organismo. Los linfocitos T no están permanentemente circulando, sino que hay una recirculación entre la sangre y los tejidos extravasculares. Esta característica los hace ser apropiados para reflejar los efectos de una exposición en cualquier área del cuerpo.
Los linfocitos circulantes, normalmente, se encuentran en fase de no división (G0). Al cultivarlos en presencia del mitógeno se estimula la división mitótica, lo que permite el estudio de los cromosomas en metafase.
Los linfocitos tienen una vida media de unos cuatro años, aunque se pueden encontrar linfocitos que pueden sobrevivir durante varias décadas. Esta propiedad es interesante, junto con el hecho de hallarse en fase de no división en el torrente circulatorio, porque permite detectar efectos clastogénicos transcurrido algún tiempo desde la exposición, ya que las lesiones en el ADN persisten.
El ensayo de aberraciones cromosómicas detecta cambios en la estructura de los cromosomas, que son visibles al microscopio óptico. Estos cambios corresponden a roturas y reordenaciones dentro de un cromosoma o entre cromosomas diferentes. Estas reorganizaciones son producidas sobre todo por aquellas sustancias que rompen directamente la cadena de ADN (p.e. radiaciones ionizantes) o que distorsionan la doble hélice de ADN (p.e. agentes intercalantes).
Las aberraciones estructurales se pueden clasificar como estables o inestables, indicando la posibilidad o no, por parte de la célula, de superar la división celular.
Las aberraciones inestables (dicéntricos, anillos, fragmentos y otras reordenaciones asimétricas) conducen a la muerte de la célula durante la división celular mitótica. Esto es debido a que las reorganizaciones producidas no permiten la división de la célula o conducen a la pérdida de fragmentos de material genético en las células hijas.
Las aberraciones estables (translocaciones equilibradas, inversiones y otras reordenaciones simétricas) pueden ser transmitidas a la progenie porque no interfieren con la división celular.
La tinción convencional que se emplea en el ensayo (tinción sin bandas) permite la detección de las aberraciones inestables, pero algunas de las aberraciones estables pueden escapar a la detección; sin embargo, se estima que la frecuencia de aparición de reordenaciones asimétricas es igual a la frecuencia de formación de reordenaciones simétricas.
Las aberraciones cromosómicas pueden ser de dos tipos atendiendo al momento del ciclo celular en el que tenga lugar la exposición: aberraciones de tipo cromatídico (afectan a una sola cromátida del cromosoma) y aberraciones de tipo cromosómico (afectan a ambas cromátidas del cromosoma) (figura 1).
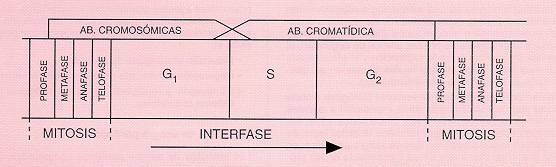
Fig. 1: Tipos de aberraciones inducidos por la exposición a agentes clastógenos según la fase del ciclo celular en que han ejercido su acción
Por otro lado, los agentes clastógenos se pueden clasificaren dos categorías según el tipo de alteración estructural que producen: agentes S-dependientes y agentes S-independientes.
Los agentes S-dependientes (radiación ultravioleta, agentes alquilantes, etc.) inducen aberraciones de tipo cromatídico en cualquier fase del ciclo celular y las alteraciones sólo se visualizan una vez la célula atraviesa la fase S del ciclo celular.
Los agentes S-independientes (radiaciones ionizantes y algunos compuestos químicos radiomiméticos como bleomicina y neocacinostatin) inducen aberraciones de tipo cromosómico cuando actúan durante las fases G0 y G1, aberraciones de tipo cromatídico durante la fase G2 y una mezcla de ambos tipos durante la fase S del ciclo celular.
Mientras los linfocitos periféricos se encuentran en la fase G0, las lesiones inducidas por los agentes radiomiméticos pueden ser reparadas inmediatamente, no reparadas, o reparadas incorrectamente, dando lugar en ciertos casos a aberraciones de tipo cromosómico. La frecuencia de estas aberraciones no se reduce excepto por dilución de la población por linfocitos no afectados o por recambio celular. Esta es la razón del porqué las aberraciones de tipo cromosómico pueden ser detectadas incluso años después del cese de la exposición.
En el caso de las lesiones inducidas por los agentes S-dependientes, éstas sólo se expresarán cuando la célula atraviese la fase S (fase de replicación del ADN), por lo que hasta que la célula sea estimulada, pueden pasar largos períodos en los que puede darse la reparación celular, de modo que sólo algunas alteraciones se mantendrán y se expresarán como aberración cuando se dé la estimulación in vitro.
Las aberraciones cromosómicas estructurales son indicadores de exposición a genotóxicos y de efectos mutagénicos. Aunque en sí no constituyen mutaciones porque, normalmente, conducen a la muerte de la célula o de su progenie, pueden originarias cuando los cromosomas rotos se restituyen o intercambian fragmentos entre ellos. Por esto se puede asumir que todos los agentes que producen roturas cromosómicas también inducen mutaciones.
En las células somáticas, parece que las aberraciones cromosómicas juegan un importante papel en la etiología o progresión del cáncer. Se han hallado anomalías cromosómicas específicas asociadas a ciertos tipos de cánceres (translocación recíproca entre los cromosomas 22 y 9 en la leucemia mieloide crónica y entre los cromosomas 8 y 14 en el linfoma de Burkitt).
Por otro lado, en el caso de tres enfermedades congénitas (síndrome de Bloom, ataxia talangiectasia y anemia de Fanconi) que predisponen al individuo a padecer un tipo específico de cáncer, se ha observado un incremento en la frecuencia de aberraciones cromosómicas en linfocitos de sangre periférica.
Las aberraciones cromosómicas se han hallado frecuentemente, además de en células cancerosas, en fetos de abortos espontáneos y en muchos individuos con alteraciones en el desarrollo. El análisis cromosómico de abortos espontáneos en humanos muestra que, en aproximadamente el 50% de los casos, presentan estructuras cromosómicas anómalas.
El mecanismo de inducción de intercambios de cromátidas hermanas y de aberraciones cromosómicas es distinto.
Los intercambios entre cromátidas hermanas son la manifestación citológica de la rotura de la doble hélice del ADN y la reorganización entre sitios homólogos de las dos cromátidas de un cromosoma. Estos cambios, que no alteran la polaridad, la estructura de la doble hélice del ADN ni la morfología de los cromosomas, pueden visualizarse mediante tinción específica por fluorescencia y/o Giemsa en linfocitos de sangre periférica que han sufrido dos ciclos celulares.
Los agentes denominados S-dependientes son eficaces inductores de intercambios de cromátidas hermanas. Al igual que para las aberraciones cromosómicas, la lesión que conduce al intercambio puede haber sido originada en cualquier fase del ciclo celular aunque no se manifiesta citológicamente hasta que la célula entra en división y atraviesa la fase S.
Frente a determinados agentes químicos, la inducción de intercambios de cromátidas hermanas puede presentar una mayor sensiblidad que las aberraciones cromosómicas, pudiendo manifestarse efectos genotóxicos a concentraciones hasta 100 veces menores a las necesarias para producir las aberraciones cromosómicas.
Los mejores inductores de intercambios de cromátidas hermanas son las sustancias que forman aductos covalentes con el ADN o que interfieren con su metabolismo precursor o de reparación.
Los intercambios de cromátidas hermanas no son sucesos letales para la célula y, probablemente, no presentan ninguna relación con la citotoxicidad. Además, por sí mismos, no pueden ser considerados mutaciones ya que, en principio, no producen cambios en la información genética.
Sin embargo, se ha observado que la frecuencia de intercambios de cromátidas hermanas aumenta cuando las células son expuestas a agentes mutágenos y cancerígenos conocidos, y en el caso de ciertas enfermedades congénitas (síndrome de Bloom y Xeroderma pigmentosum).
El control biológico se puede aplicar al estudio de grupos de individuos con una presumible o conocida exposición a genotóxicos, a fin de determinar su grado de absorción de un tóxico o detectar sus efectos. Tanto la absorción del genotóxico como sus efectos biológicos suelen ser considerados determinantes del potencial peligro derivado de una exposición. La observación de alguno de estos fenómenos ha de ser razón suficiente para tomar unas medidas preventivas.
Los linfocitos pueden acumular lesiones debidas a la exposición repetida o prolongada, lo cual los convierte en, teóricamente, un tipo celular ideal para detectar daños debidos a exposiciones crónicas y a bajas dosis de agentes genotóxicos.
La exposición a una variedad de agentes, tanto físicos como químicos, puede resultar en un incremento en la frecuencia de aberraciones cromosómicas y/o intercambio de cromátidas hermanas en linfocitos de sangre periférica de individuos expuestos (tabla 1). Por ello, las técnicas citogenéticas pueden ser usadas para establecer, en una población determinada, el daño derivado de una exposición y para estimar el potencial riesgo para la salud.
Tabla 1: Resultados publicados de ensayos citogenéticos con linfocitos de sangre periférica en poblaciones expuestas ocupacionalmente a distintos agentes |
|
Un incremento en la frecuencia de aberraciones cromosómicas en una población se suele considerar como un indicador de incremento del riesgo de cáncer, pero los ensayos citogenéticos no pueden predecir riesgo de cáncer para individuos puntuales.
Aunque las aberraciones cromosómicas y los intercambios de cromátidas hermanas se detectan en diferentes poblaciones de linfocitos (de 1ª y 2ª división celular, respectivamente), y las lesiones que se producen pueden ser diferentes, estos indicadores son complementarios y suelen utilizarse ambos en el estudio de poblaciones expuestas a mutágenos.
(1) CEC
Indicators for assessing exposure and biological effects of genotoxic chemicals
Ed. A. Aitio, G. Becking, A. Berlin, A. Bernard, V. Foa, D. Kello, E. Kaug, A.
Léonard, G. Nordberg. Commission of the European Communities. Luxembourg, 1988, EUR 11642
EN
(2) AU, W. W.
Monitoring human populations for effects of radiation and chemical exposures using
cytogenetictechniques
Occup. Med., 199 1, Vol. 6, (4): 597-611
(3) CARRANO, A. V.
Chromosomal alterations as markers of exposure and effect
J. Occup. Med., 1986, Vol. 28, (10):1112-1116
(4) CARRANO, A. V. AND A. T. NATARAJAN
Considerations for population monitoring using cytogenetic techniques
Mutat. Res., 1988, 204: 379-406
(5) PERERA, F.
Biomarkers and molecular epidemiology of occupationally related cancer
J. Toxicol. Environ. Health, 1993, 40:203-215
(6) RAPPAPORT, S. M.
Biological considerations in assessing exposures to genotoxic and carcinogenic agents
Int. Arch. Occup. Environ. Health, 1993, 65: S29-S35
(7) REGIDOR, L., X. SOLANS Y A. HUICI
Consideraciones en torno a la prevención del cáncer de origen laboral
Salud y Trabajo, 1994, Nº 101: 4-7
(8) SASAKI, M.
Role of chromosomal mutation in the development of cancer
Cytogenet. Cell Genet., 1982, 33: 160-168
(9) SORSA, M., A. OJAJÄRVI AND S. SALOMAA
Cytogenetic surveillance of workers exposed to genotoxic: chemicals
Teratogen., Carcinogen. and Mutagen., 1990, 10:215-221